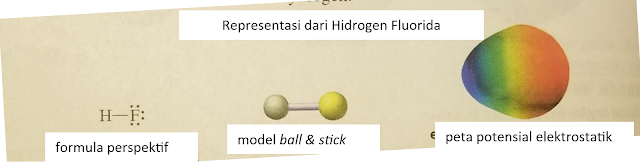
Yang disebut dengan hidrogen halida adalah ikatan hidrogen dengan atom dalam anggota golongan halogen, yaitu F, Cl, Br, I, sehingga membentuk senyawa HF, HCl, HBr, HI.
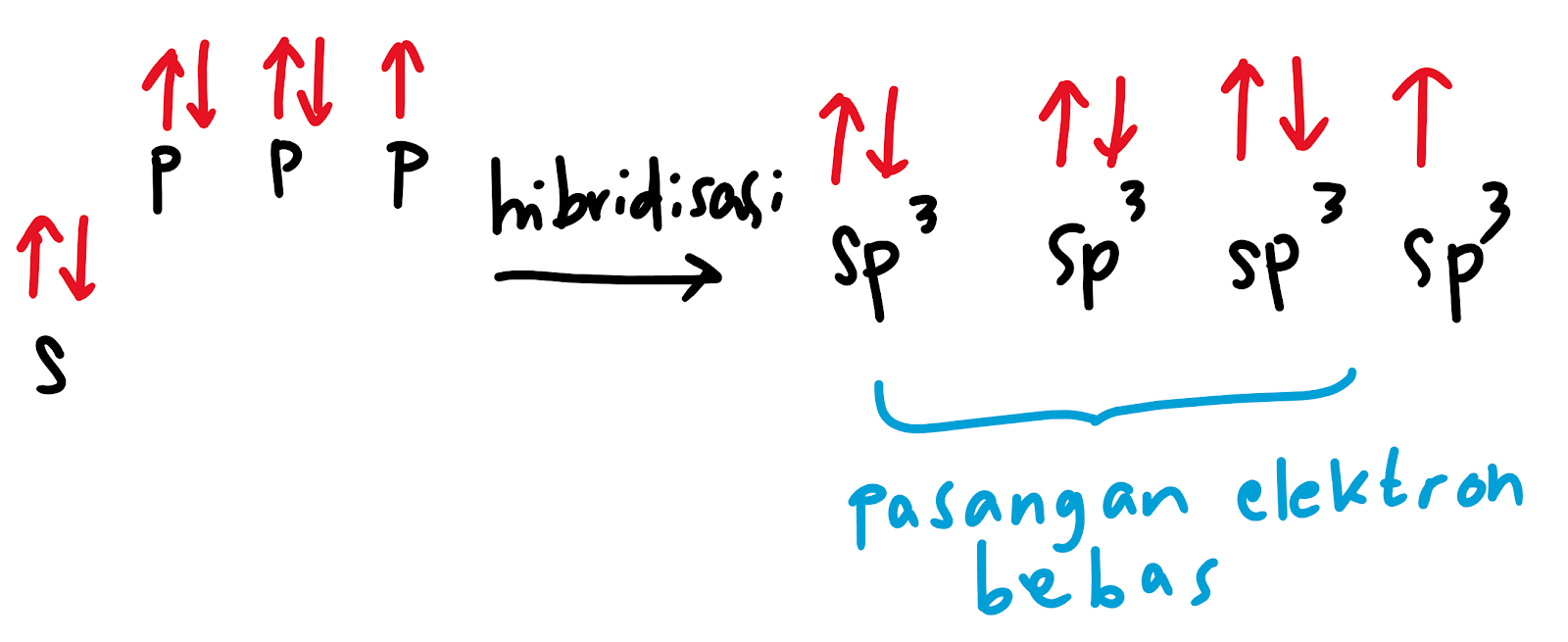
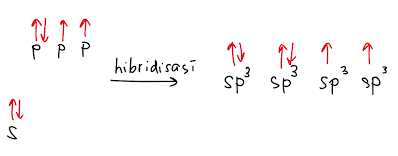
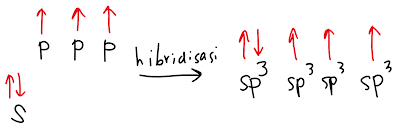
Diketahui bahwa pada atom halogen, terdapat 7 elektron valensi sehingga seluruh orbital terisi penuh kecuali 1 orbital yang hanya terisi 1 elektron. Oleh karena itu hibridisasi yang terbentuk adalah sp3.
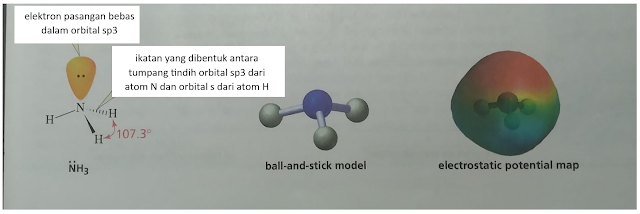
Dengan demikian ikatan yang terbentuk antara atom halogen dan hidrogen adalah antara orbital sp3 dari atom halogen dan s dari hidrogen.
Peta pontensial elektriknya tampak seperti di bawah, dan juga dapat dilihat bagaimana molekul terbentuk membentuk linear.
Menarik membahas ikatan pada hidrogen halida, dimana tiap atom halogen dalam tabel periodik berada pada golongan yang sama tapi pada periode yang berbeda, sehingga perbedaan letaknya pada periode tersebut membedakan pula posisi elektron valensi, semakin urutan dalam tabel ke bawah, semakin jauh posisi elektron valensinya.
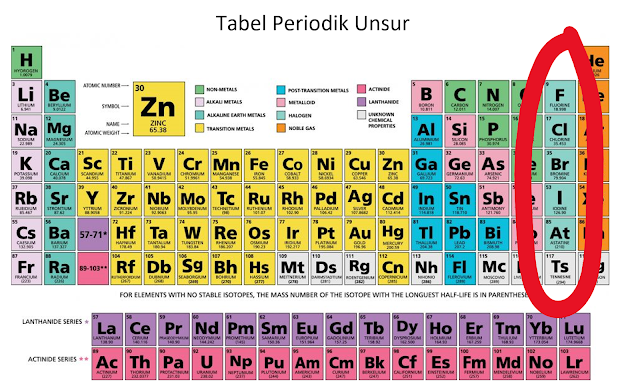 |
| atom Halogen berada dalam lingkaran merah |
Elektron valensi atom fluorin terletak pada kulit kedua elektron (sebagaimana nomor atom fluorin adalah 9, sehingga konfigurasi elektronnya adalah 1s2 2s2 2p5, angka 2 di depan menunjukkan posisi elektron), sementara elektron valensi klorin terletak pada kulit ketiga (nomor atom klorin adalah 17, konfigurasi elektronnya adalah 1s2 2s2 2p6 3s2 3p5) dan seterusnya. Perbedaan ini menyebabkan jarak antara nukleous dengan elektron valensi yang berikatan berbeda, semakin berada di posisi kulit elektron dalam angka yang besar, semakin jauh jaraknya. Jadi dalam hal ini, jarak elektron valensi klorin lebih jauh daripada fluorin.
Semakin jauh jarak juga menggambarkan semakin berkurangnya densitas elektron selaras juga dengan berkurangnya kekuatan ikatan. Sebagai perbandingan, dapat dilihat pada gambar di bawah:
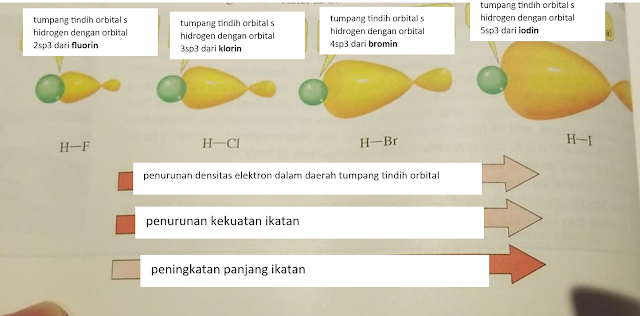 |
Densitas elektron dari HF > HCl > HBr > HI berkurang. Dalam arti HF memiliki densitas elektron lebih besar dari HCl, HCl lebih besar dari HBr, dan HBr lebih besar dari HI.
Menurutku mengapa densitas elektronnya pada HF besar, karena jarak ikatannya kecil, maka elektron yang ada makin rapat, saking sempitnya. Berbeda pada HI yang jarak ikatannya makin besar, elektron dapat dengan leluasa berada, sehingga tidak terlalu rapat, oleh karena itulah densitas elektron pada HI lebih kecil dari HF.
Begitu juga kekuatan elektronnya, ikatan elektron HF menjadi yang paling besar di antara lainnya. Menurutku juga kaitannya dengan densitas elektronnya yang besar pada HF, memungkinkan antar elektron untuk mudah berinteraksi dan memperkuat ikatan, sementara pada HI, yang mana elektronnya berpencar jauh saking luasnya jarak, menjadi sulit untuk saling memperkuat ikatan.
Tetapi, panjang ikatan bersifat menaik, semakin ke HI, semakin panjang ikatannya, sehingga sifatnya menjadi begini HF< HCl < HBr < HI.
HI memiliki panjang ikatan yang lebih besar dari HBr, HBr lebih besar dari HCl, HCl lebih besar dari HI. Tentu saja panjang ikatan ini berkaitan dengan besarnya jarak ikatan, ketika semakin besar jaraknya, ikatan menjadi semakin panjang.
Rangkuman data secara hitungan saintifik dapat dilihat dalam tabel di bawah:
Sekian untuk pembahasan mengenai ikatan pada hidrogen halida kali ini. Semoga dapat bermanfaat. Mohon maaf apabila ada salah. Terima kasih sudah berkunjung ^^