 |
| Sumber Gambar: www.csee-etuce.org |
Pada pertemuan kedua ini, ada banyak yang dipelajari seputar mata kuliah farmasi industri (Alhamdulillah saya tidak mengantuk, jadi ada banyak yang dicatat), mulai dari sistem manajemen mutu hingga CPOB. Jadi, sebagian yang saya tulis di sini adalah apa yang saya tulis di catatan saya, berhubung dosen baru memberikan hand out-nya setelah pertemuan kedua ini serta dosen lebih banyak bercerita dan menjelaskan di luar yang ditulis di hand out-nya. Meskipun demikian, tetap ada beberapa yang saya ambil dari hand out-nya.
Mulai dari sistem manajemen mutu, sistem ini yang dipakai untuk mengelola industri terdiri dari 3 bagian utama, yaitu pemastian mutu, Cara Pembuatan Obat yang Baik (CPOB), dan pengawasan mutu. Mengenai pemastian mutu telah dipelajari di pertemuan pertama.
Mengenai kegiatan yang ada pada pengawasan mutu, tidak jauh dari kegiatan-kegiatan yang dilakukan di laboratorium pengawasan mutu. Gambaran kegiatannya adalah seperti yang mahasiswa pernah alami saat praktikum analisis bahan baku farmasi atau analisis sediaan farmasi. Jadi pengawasan mutu bertanggung jawab terhadap suatu material baik bahan baku, bahan jadi, maupun pengemas. Dalam praktiknya, yang dianalisis adalah sampel atau contohnya. Fungsi dari adanya pengawasan mutu ini adalah untuk memastikan bahwa semua bahan telah memenuhi persyaratan, termasuk air yang digunakan. Mengenai air, ada suatu persyaratan khusus yang tidak dibahas pada pertemuan ini.
Dalam hal ini, pengawasan mutu harus bersifat independen, tidak boleh dibawahi oleh bagian produksi, untuk mencegah KKN. Di bawah ini adalah persyaratan dasar dari pengawasan mutu.
- Sarana dan prasarana yang memadai.
- Personil yang terlatih.
- Prosedur yang disetujui tersedia untuk (a) pengambilan sampel (bahan awal, bahan pengemas, produk antara, produk ruahan, dan produk jadi), (b) pemeriksaan dan pengujian bahan, (c) pemantauan lingkungan.
- Produk jadi berisi zat aktif dengan komposisi secara kualitatif dan kuantitatif sesuai dengan yang disetujui pada saat pendaftaran, dengan derajat kemurnian yang dipersyaratkan serta dikemas dalam wadah yang sesuai dan diberi label yang benar.
- Dibuat catatan hasil pemeriksaan dan analisis bahan dan dibandingkan terhadap spesifikasi.
- Sampel pertinggl dari bahan awal da produk jadi disimpan dalam jumlah yang cukup untuk dilakukan pengujian ulang bila perlu. Sampel produk jadi disimpan dalam kemasan akhir kecuali untuk kemasan yang besar.
Sebelum dilakukan analisis seluruh peralatan yang digunakan termasuk software harus divalidasi. Jadi, jangan mentang-mentang peralatan buatan merk terkenal misal Shima*zu, maka tidak divalidasi. Kemudian, sebagaimana yang telah dijelaskan di pertemuan sebelumnya, bagian pengawasan mutu tidak boleh begitu saja mengeluarkan laporan suatu bahan tidak memenuhi persyaratan, misalnya persyaratan kadarnya antara 95 sampai 105%, hasil pemeriksaan 90%. Penemuan ini harus dikaji terlebih dahulu, bisa jadi terjadi kesalahan pada sistem peralatannya, atau petugasnya yang salah prosedurnya.
Dosen bertanya, apa yang dimaksud dengan validasi? Tidak ada yang menjawab, jujur kita pernah mempelajarinya di S1, namun lupa :p
Validasi itu dilakukan agar dapat diperoleh data yang konsisten. Validasi metode analisis dan validasi proses itu berbeda. Namun, tidak dijelaskan seperti apa perbedaannya. Yang jelas pada validasi metode analisis itu seperti yang akurasi, presisi, rentang, linieritas, dan sebagainya.
Selain itu, tidak mudah pula meloloskan suatu bahan. Perlu untuk mengumpulkan seluruh data hasil uji dari tiap periode waktu. Misalnya memang telah jelas persyaratan kadar bahan tersebut adalah 95 sampai 105%, berdasarkan data yang dikumpulkan rata-rata kadar bahan tersebut adalah 97-103%, ketika dalam pengujian diperoleh kadar 95% meskipun masih sesuai dengan persyaratan spesifikasi bahan tersebut, penemuan ini perlu dikaji lagi karena tidak sesuai dengan tren kadar rata-ratanya. Sehingga hasil penemuan ini dianggap tidak konsisten, jadi harus dievaluasi, kejadian ini disebut "out of tren".
Jadi, pengkajian mutu produk harus dilakukan tiap tahun dan didokumentasikan, dengan mempertimbangkan hasil kajian ulang sebelumnya dan hendaklah meliputi paling sedikit:
- Bahan awal dan bahan pengemas yang digunakan untuk produk, terutama yang dipasok dari sumber baru.
- Pengawasan selama proses yang kritis dan hasil pengujian obat jadi.
- Semua bets yang tidak memenuhi spesifikasi yag ditetapkan dan investigasi yang dilakukan.
- Kajian terhadap semua penyimpangan atau ketidaksesuaian yang signifikan dan efektivitas hasil tindakan perbaikan dan pencegahan.
- Semua perubahan yang dilakukan terhadap proses atau metode analisis.
- Variasi yang diajukan, disetujui, ditolak, dari dokumen registrasi yang telah disetujui termasuk dokumen registrasi untuk ekspor.
- Hasil program pemantauan stabilitas dan segala tren yang tidak diinginkan.
- Keluhan, produk kembalian, dan penarikan obat yang terkait dengan mutu produk termasuk investigasi yang telah dilakukan
- Kajian kelayakan terhadap tindakan perbaikan proses produk atau peralatan yang sebelumnya.
- Kajian terhadap komitmen pasca pemasaran dilakukan pada obat yang baru mendapatkan persetujuan pendaftaran dan obat dengan persetujuan pendaftaran variasi.
- Status kualifikasi peralatan dan sarana yang relevan misal sistem tata udara, air, gas bertekanan, dan lain-lain.
- kesepakatan teknis untuk memastikan selalu up to date.
Selain pemastian mutu, CPOB, dan pengawasan mutu, sekarang juga diminta adanya "Manajemen Risiko Mutu". Hal ini berangkat dari adanya kesadaran bahwa risiko ada di mana-mana. Mulai dari regulasi, produksi, dan sebagainya. Contohnya pada produksi, ada risiko terkontaminasinya parasetamol dengan air sehingga dapat menyebabkan terjadinya hidrolisis. Jadi, adanya potensi risiko harus dikaji.
Dosen melanjutkan dengan memberikan ilustrasi, mulai dari memberikan perbandingan saat pembuatan tablet di waktu praktikum dengan pembuatan tablet di industri. Jika saat praktikum diajarkan bahwa dalam membuat tablet itu ada tahap ketika harus dihentikan pengadukan ketika bahan sudah dapat dikepal. Bagaimana ketika dibuat di industri dalam skala besar? Bagaimana mengepalnya? Oleh karena itu, di industri bukan itu parameternya, melainkan daya listrik dan putaran mixer-nya. Ketika bahan sudah makin kental, maka daya listrik yang dibutuhkan juga akan makin besar, ketika terjadi perubahan daya listrik ke arah besaran yang ditetapkan, maka tahap tersebut dapat dihentikan dan menunjukkan bahwa bahan siap dilanjutkan ke tahap berikutnya. Mengenai hal ini, dapat terjadi suatu hal yang menyebabkan kurangnya kadar air sehingga berikutnya sulit dikempa atau dicetak, potensi risiko seperti inilah yang harus dikaji, agar ketika mengalami permasalahannya sudah mengetahui apa yang harus dilakukan. Mulai dari menilai faktor-faktor apa saja yang dapat menyebabkan kurangnya kadar air hingga faktor-faktor apa saja yang dapat mendukung pembuatan obat yang baik.
Hal ini sama saja apabila dianalogikan dengan bank yang meminjamkan uang kepada peminjam. Bank akan melakukan serangkaian kajian untuk menilai apakah peminjam dapat memberikan jaminan bahwa peminjam tersebut dapat mengembalikan uangnya. Di pabrik obat, perlu dilakukan kajian-kajian, apakah proses yang akan terjadi dapat menjamin dibuatnya obat dengan baik.
Di situlah adanya peran apoteker, yaitu mengawal dan menangani semua hal yang terkait dalam pembuatan obat di pabrik. Supaya benar apoteker dalam mengerjakannya, maka perlu adanya prosedur yang telah dibakukan dan disahkan.
Salah satu persyaratan CPOB adalah tersedianya sarana dan fasilitas, salah satunya berupa bangunan, sarana penunjang, dan peralatan untuk produksi obat. Sebelum membahas ini, ada mahasiswa yang bertanya, "Untuk pabrik yang melakukan toll in apakah harus CPOB juga?" Sebelumnya, dikenalkan dulu dengan istilah "toll in" dan "toll out". Toll in merupakan istilah apabila suatu pabrik menerima proses pembuatan obat dari pabrik lain karena alasan tertentu, sementara toll out merupakan istilah aktivitas pabrik yang memberikan proses pembuatan obatnya tersebut kepada pabrik lain. Jawabannya adalah bahwa keduanya harus CPOB, kata dosen, pabrik yang toll out juga harus diinspeksi, jika tidak memenuhi CPOB maka jangan diterima. Tentunya dalam kegiatan tersebut terdapat kontrak kerja, mengenai ini penjelasannya akan lebih panjang, sehingga tidak terlalu dibahas di kelas.
Obat yang bermutu untuk tetap bisa bermutu sampai konsumen, selama distribusi juga harus baik prosedurnya, jadi ada juga istilah CDOB (Cara Distribusi Obat yang Baik). Jadi kembali lagi, mutu dari suatu produk secara umum, itu bukan suatu hal yang kebetulan, melainkan dibangun, karena produk dapat berkualitas tergantung dari orang yang membuatnya. Dari hal itu, terdapat suatu istilah "Jika suatu kualitas tidak ada dalam diri orang yang membuatnya, maka seumur hidup juga tidak akan ada kualitas dari produknya".
Selain itu, ada banyak hal yang dapat mempengaruhi kualitas obat seperti temperatur, kebersihan udara, cahaya, aliran udara, kelembapan, tekanan udara di ruangan, kontaminasi partikel, dan kontaminasi mikroba. Mengenai temperatur, temperatur yang tidak sesuai tidak hanya dapat menyebabkan obat rusak, tetapi juga misalnya ketika suhu terlalu tinggi, seseorang yang bekerja di suhu panas akan mengalami peningkatan metabolisme, berkeringat, cepat lelah, kemudian kesalahan dapat terjadi.
Mengenai kebersihan udara, secara pengamatan visual bisa saja mengatakan bahwa udaranya bersih, tetapi secara mikroskopis belum tentu, masih bisa ada partikel-partikel debu bahkan mikroba yang dapat mengkontaminasi obat sehingga dapat mempengaruhi kualitasnya juga. Oleh karena itulah, di pabrik terdapat aliran udara, sebagai cara untuk menjaga udara agar bersih.
Ketika membangun pabrik, juga ada yang harus diperhatikan, seperti iklim, tetangga, pengawasan terhadap limbah, listrik, air, mudah dibersihkan, dan sanitasi.
- Iklim, terkait dengan letak geografis.
- Tetangga, yaitu pabrik yang dibangun berdekatan. Harus diketahui, jenis pabrik seperti apa tetangga tersebut, apakah pabrik kimia, makanan, dan lainnya, serta seperti apa tata udaranya. Kaitannya dengan ada atau tidaknya pengaruh aktivitas pabrik tersebut terhadap pabrik yang dibangun ini.
- Pengawasan terhadap limbah, tidak hanya limbah cair, tapi kebisingan juga perlu dipertimbangkan, misalnya terdapat pabrik las dalam skala besar, kebisingan dapat mempengaruhi ketenangan dan konsentrasi pekerja yang membuat obat.
- Bangunan juga harus mudah dibersihkan. Karena pembuatan obat juga diburu waktu atau pemanfaatan waktu dengan efektif, setiap bagian bangunan harus mudah dibersihkan, agar tidak membuang-buang waktu hanya untuk membersihkan bagian itu saja. Oleh karena itulah, pabrik dibangun dengan kriteria khusus, misalnya dindingnya tidak boleh bersudut, dan lainnya, agar mudah dibersihkan. Lantainya juga tidak boleh keramik, dan seterusnya.
- Sanitasi, terkait dengan saluran, perlu untuk dihindari masuknya hewan ke dalam pabrik. Kalaupun ada hewan yang tidak diinginkan dapat masuk, perlu dianalisis bagaimana bisa hewan tersebut masuk, supaya berikutnya dapat dicegah. Satu nyamuk pun yang dapat masuk pada ruang produksi, dapat menggegerkan seisi pabrik.
Dalam merancang bangunan ada prinsipnya, misalnya ada yang berwarna merah artinya harus dipisah seperti beta laktam, hormon seks, sitotastik, dan lainnya. Sementara yang berwarna hijau dapat berada dalam satu gedung tapi terpisah ruangannya, misalnya dipisah dalam beda lantai, misal lantai 1 asam mefenamat, lantai 2 parasetamol. Yang berwarna merah itu, tidak hanya beda gedungnya, tapi seluruh sistem termasuk lisrik, air, tata udara juga harus terpisah.
Alur proses, material, dan personalia juga harus jelas, di dalam pabrik harus ada penandaan area menerma barang, area penimbangan, pengolahan, serta ruagan khusus. Untuk area granulasi karena bisa menghasilkan banyak debu, maka harus dipisah areanya.
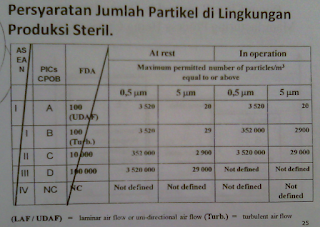
Pada daerah produksi dan pengemasan ada beberapa hal yang peru diperhatikan. Setelah granulasi kering, ruangan tersebut tidak boleh ada pipa-pipa, dikhawatirkan akan ada partikel-partikel akibat proses granulasi kering yang menempel pada pipa-pipa dan susah dibersihkan. Oleh karena itu dalam hal ini, sebenarnya ada pembagian daerah pada pabrik yaitu menjadi kelas A-G, di mana perbedaannya pada jumlah partikel yang diperbolehkan ada, jadi beda kelas, beda jumlah partikel yang diperbolehkan adanya.
Alur proses, material, dan personalia juga harus jelas, di dalam pabrik harus ada penandaan area menerma barang, area penimbangan, pengolahan, serta ruagan khusus. Untuk area granulasi karena bisa menghasilkan banyak debu, maka harus dipisah areanya.
Pada daerah produksi dan pengemasan ada beberapa hal yang peru diperhatikan. Setelah granulasi kering, ruangan tersebut tidak boleh ada pipa-pipa, dikhawatirkan akan ada partikel-partikel akibat proses granulasi kering yang menempel pada pipa-pipa dan susah dibersihkan. Oleh karena itu dalam hal ini, sebenarnya ada pembagian daerah pada pabrik yaitu menjadi kelas A-G, di mana perbedaannya pada jumlah partikel yang diperbolehkan ada, jadi beda kelas, beda jumlah partikel yang diperbolehkan adanya.
Pembagian kelas juga didasarkan atas perbedaan risiko terapetiknya. Kelas untuk risiko terapetik paling tinggi adalah kelas A, sementara kelas yang paling tidak berisiko terapetik adalah kelas G. Untuk obat nonsteril sebenarnya tidak pernah ditetapkan, hanya ada kelas A, B, C, D saja. Namun, di Indonesia dimodifikasi dengan adanya penambahan kelas E, F, dan G sehingga masalah standar untuk obat nonsteril dapat diatasi.
Mengenai debu atau partikel, mutlak untuk dipenuhi batasan jumlahnya pada tiap kelas. Sebelum mengetahui masing-masing jumlah partikel dari tiap kelas, ada baiknya untuk mengetahui macam-macam debu atau partikel, yaitu:
- Coarse dust: 50 sampai 500 mikrometer.
- Fine dust: 1 sampai 50 mikrometer.
- Ultra fine dust: kurng dari 0,5 sampai 1 mikrometer.
- Partikel: kurang dari 0,05 mikrometer.
Untuk mencapai syarat dari kelas A, digunakan UDAF (Uni Directional Air Flow). Dalam kelas-kelas ini jadi ada syaratnya, dalam 1 meter kubik, berapa jumlah partikel yang diperbolehkan. Contohnya pada kelas A yang diperbolehkan pda saat istirahat atau tidak sedang proses produksi, jumlah partikl ukuran 0,5 mikrometer yang diperbolehkan adalah 3.520, dan seterusnya. Dalam hal ini, ada alat yang dapat menghitung jumlah partikel, yaitu particle counter, alat ini dapat menghisap udara 1 meter kubik, lalu menghitung jumlah partikelnya.
Kelas E digunakan untuk pencampuran bahan, kelas F unuk pengemasan sekunder. Di kelas F tidak ditentukan jumlah partikelnya, karena alatnya bisa rusak saking banyaknya jumlah partikel. Particle counter juga harganya mahal, jadi amat disayangkan jika rusak.
Pada kelas A, B, C, dan D, tidak hanya ada syarat jumlah partikel yang diperbolehkan saja, tetapi juga ada syarat jumlah mikrobanya, yaitu:
Ada banyak macam alat penghitung jumlah mikroba, antara lain MAS, SAS, dan RES. Prinsipnya sama dengan alat penghitung partikel, yaitu udara dihisap lalu dilewatkan pada cawan petri, setelah jumlah udara cukup, diambil cawan petri, lalu diinkubasi untuk menumbuhkan mikroba.
Mengenai kelas-kelas macam ini, ISO telah mengeluarkannya dengan jumlah kelas lebih banyak. Kelas A sampai G merupakan kelas-kelas yang ada pada CPOB, sementara di industri lainnya, ISO telah menetapkan kelasnya, seperti pada ISO 1, diperuntukkan untuk industri satelit yang mana sama sekali tidak boleh ada debu, jadi untuk partikel dengan ukuran 0,5 mikrometer, sama sekali tidak boleh ada. Ini menunjukkan adanya kelas yang lebih ketat terkait jumlah partikelnya dibandingkan dengan kelas A. Berdasarkan ISO, kelas A dan B masuk ke kelas ISO 5, kelas C masuk ke kelas ISO 7, dan kelas D ke ISO 8.
Mengenai ini, ada juga suatu sistem yang disebut dengan HVAC (Heating, Ventilation, and Air Conditioning). Fungsinya adalah menjaga udara di sekitar. Salah satu komponen tersebut adalah primary filter. Primary filter bentuknya seperti kantong pada vacuum cleaner.
Demikian yang dapat saya sampaikan. Mohon maaf apabila terdapat kesalahan. Semoga bermanfaat dan terima kasih sudah berkunjung :D












0 comments:
Post a Comment
If you want to be notified that I've answered your comment, please leave your email address. Your comment will be moderated, it will appear after being approved. Thanks.
(Jika Anda ingin diberitahu bahwa saya telah menjawab komentar Anda, tolong berikan alamat email Anda. Komentar anda akan dimoderasi, akan muncul setelah disetujui. Terima kasih.)